- Artículo
- Fuente: Campus Sanofi
- 22 nov 2023
Consecuencias de un fallo de movilización: "mejor no perder el tren"

Pese a los avances en el tratamiento movilizador, aún un número importante de pacientes no consigue suficientes progenitores hematopoyéticos como para abordar un trasplante autólogo. Un fallo de movilización empeora el pronóstico de los pacientes, por lo que es necesario optimizar la primera estrategia de movilización para minimizar esta posibilidad.
El trasplante autólogo de progenitores hematopoyéticos (PH) es una modalidad de tratamiento consolidada en múltiples enfermedades hematológicas y no hematológicas1. Actualmente, los PH se obtienen de sangre periférica movilizada en prácticamente todos los casos (99,8%) 1, por lo que debe planificarse la movilización y recolección de PH en el momento adecuado antes de proceder con el trasplante.
Un fallo de movilización se define como la incapacidad de alcanzar 2x106 células CD34+ por Kg del paciente para abordar el trasplante. Los esquemas de movilización utilizando G-CSF (con o sin quimioterapia previa) ofrecen un porcentaje variable de fallos de movilización del 20-40% 2. Gracias al uso de plerixafor, generalmente con la estrategia preventiva, este porcentaje se ha reducido a <10% en la mayoría de series2, pero aún un importante número de pacientes fallan a la movilización y suponen un reto médico.
Los pacientes con un fallo de movilización tienen marcado peor pronóstico con respecto a los buenos movilizadores3,4. Por un lado, un mal movilizador tiene un alto riesgo de volver a presentar un fallo de movilización (del 28 al 82%, según esquemas) 5. Si el paciente no consigue suficientes PH para la realización del trasplante, no podrá beneficiarse del efecto terapéutico del mismo (Tabla 1). En patologías como el mieloma múltiple, el linfoma de Hodgkin y otros linfomas de alto grado el trasplante autólogo supone claramente una disminución en el riesgo de recaída 6-9; en otras patologías el trasplante autólogo puede ser sustituido por alternativas razonables, como por ejemplo ciclos adicionales de citarabina a dosis altas en la leucemia mieloblástica aguda10 o mantenimiento con inmunoterapia en el linfoma folicular 11, con lo que el primer fallo de movilización puede condicionar un cambio en la estrategia inicial de tratamiento.
Por otro lado, los pacientes con enfermedad refractaria y estadios avanzados movilizan peor12, por lo que un mal movilizador puede ser también una consecuencia del mal pronóstico inherente a la enfermedad. Además, una nueva movilización retrasa inevitablemente la continuación del tratamiento, lo cual puede favorecer recaídas o aumentar la enfermedad residual pretrasplante, empeorando por tanto la respuesta global al tratamiento13-15.
Por último, muchos pacientes pueden percibir ansiedad y frustración a consecuencia de estos fracasos, además de sufrir mayor número de efectos adversos derivados de las movilizaciones12, por no hablar del incremento en los costes16.
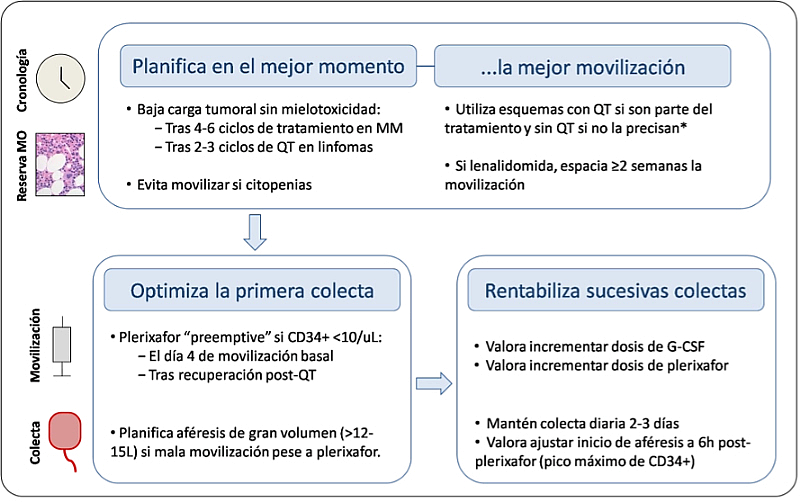
Todo ello apoya la elaboración de una estrategia de primera movilización que consiga el mayor porcentaje de éxito. Será fundamental: a) encontrar el momento idóneo para planificar la movilización, b) utilizar todas las posibilidades farmacológicas de forma secuencial y personalizada, y c) optimizar las aféresis e intensificar la movilización si es necesario (Figura 1). En este sentido, el uso de plerixafor basado en recuentos de CD34+ <10-20 células/µL en la víspera de la aféresis es el más extendido, ya que ha demostrado ser el más eficaz y coste-eficiente16.
Pese a la optimización de este primer intento, algunos pacientes no conseguirán la diana de 2x106 células CD34+/Kg. Sin embargo, algunos lo conseguirán en una segunda movilización, o se considerará adecuado abordar el trasplante con una celularidad >1-1,5 x106CD34+/kg asumiendo el riesgo de retrasar el injerto. Es importante intentar conseguir este segundo objetivo, ya que aquellos malos movilizadores que finalmente sí consiguen proceder con el trasplante, mejoran su pronóstico global17.
En conclusión, el fallo de movilización empeora el pronóstico de los pacientes y encarece y dificulta el tratamiento de la enfermedad de base, por lo que es necesario optimizar la estrategia de primera movilización para minimizar esta posibilidad.
Tabla 1. Enfermedades con indicación de trasplante autólogo de PH y el beneficio que ofrecen al realizarse.
|
Enfermedad |
Indicación |
Resultado |
|
Mieloma Múltiple |
Consolidación tras tratamiento de 1ª línea |
Aumenta SLE [6] |
|
Linfoma del Manto |
Consolidación tras tratamiento de 1ª línea |
Aumenta SLE y SG [7] |
|
Linfoma Difuso de Células Grandes B |
1ª recaída |
Aumenta la SLE [8] |
|
Linfoma Folicular |
1ª recaída o posteriores |
Aumenta SLE (más cuestionado tras la incorporación de mantenimiento con rituximab) [11] |
|
Linfoma de Hodgkin |
1ª recaída o refractariedad quimiosensible tras 1ª línea |
Aumenta SLE [9] |
|
Leucemia Mieloblástica Aguda |
Consolidación en pacientes con riesgo de recaída intermedio/bajo en 1ª remisión completa y con EMR negativa |
Consigue similares resultados que el alo-TPH, con menor toxicidad. Alternativa: ciclos adicionales de citarabina a dosis intermedias/altas. [10] |
|
Tumores sólidos* |
1ª línea en pacientes de alto riesgo o en recaída |
Aumenta SLE [18-20] |
|
Enfermedades autoinmunes** |
Formas agresivas y refractarias a tratamiento inmunosupresor. |
Reduce brotes y frena la progresión de la enfermedad [21,22] |
SLE: supervivencia libre de enfermedad; SG: supervivencia global. *Tumores germinales, neuroblastoma, Sarcoma de Ewing, etc. **Esclerosis Múltiple, Esclerosis Sistémica.
Figura 1. Estrategias propuestas para optimizar el primer intento de movilización.
.jpg)
MM: mieloma múltiple; QT: quimioterapia. *Similar eficacia, pero más toxicidad el uso combinado de QT + G-CSF vs. G-CSF solo [23].
Autora

Dra. Inés Gómez Seguí
Servicio Hematología y Hemoterapia
Hospital Universitari i Politécnic la Fe, Valencia

Referencias
- Passweg, J. R., Baldomero, H., Chabannon, C., Basak, G. W., de la Cámara, R., Corbacioglu, S., et al., & European Society for Blood and Marrow Transplantation (EBMT) (2021). Hematopoietic cell transplantation and cellular therapy survey of the EBMT: monitoring of activities and trends over 30 years. Bone marrow transplantation, 56(7), 1651–1664.
- Giralt, S., Costa, L., Schriber, J., Dipersio, J., Maziarz, R., McCarty, J., et al. (2014). Optimizing autologous stem cell mobilization strategies to improve patient outcomes: consensus guidelines and recommendations. Biology of blood and marrow transplantation : journal of the American Society for Blood and Marrow Transplantation, 20(3), 295–308.
- Pavone, V., Gaudio, F., Console, G., Vitolo, U., Iacopino, P., Guarini, A., et al. (2006). Poor mobilization is an independent prognostic factor in patients with malignant lymphomas treated by peripheral blood stem cell transplantation. Bone marrow transplantation, 37(8), 719–724.
- Yiğenoğlu, T. N., Başcı, S., Ulu, B. U., Bakırtaş, M., Kılınç, A., Şahin, D., et al. (2020). Inferior prognosis in poor mobilizing myeloma patients. Transfusion and apheresis science : official journal of the World Apheresis Association : official journal of the European Society for Haemapheresis, 59(3), 102722.
- Pusic, I., Jiang, S. Y., Landua, S., Uy, G. L., Rettig, M. P., Cashen, A. F., et al. (2008). Impact of mobilization and remobilization strategies on achieving sufficient stem cell yields for autologous transplantation. Biology of blood and marrow transplantation : journal of the American Society for Blood and Marrow Transplantation, 14(9), 1045–1056.
- Koreth, J., Cutler, C. S., Djulbegovic, B., Behl, R., Schlossman, R. L., Munshi, N. C., et al. (2007). High-dose therapy with single autologous transplantation versus chemotherapy for newly diagnosed multiple myeloma: A systematic review and meta-analysis of randomized controlled trials. Biology of blood and marrow transplantation: journal of the American Society for Blood and Marrow Transplantation, 13(2), 183–196.
- Dreyling, M., Lenz, G., Hoster, E., Van Hoof, A., Gisselbrecht, C., Schmits, R., et al. Early consolidation by myeloablative radiochemotherapy followed by autologous stem cell transplantation in first remission significantly prolongs progression-free survival in mantle-cell lymphoma: results of a prospective randomized trial of the European MCL Network. Blood 2005; 105: 2677-2684.
- Mounier, N., Canals, C., Gisselbrecht, C., Cornelissen, J., Foa, R., Conde, E., et al. & Lymphoma Working Party of European Blood and Marrow Transplantation Registry (EBMT) (2012). High-dose therapy and autologous stem cell transplantation in first relapse for diffuse large B cell lymphoma in the rituximab era: an analysis based on data from the European Blood and Marrow Transplantation Registry. Biology of blood and marrow transplantation: journal of the American Society for Blood and Marrow Transplantation, 18(5), 788–793.
- Schmitz, N., Pfistner, B., Sextro, M., Sieber, M., Carella, A. M., Haenel, M., et al., German Hodgkin's Lymphoma Study Group, & Lymphoma Working Party of the European Group for Blood and Marrow Transplantation (2002). Aggressive conventional chemotherapy compared with high-dose chemotherapy with autologous haemopoietic stem-cell transplantation for relapsed chemosensitive Hodgkin's disease: a randomised trial. Lancet (London, England), 359(9323), 2065–2071.
- Ferrara F, Picardi A. Is There Still a Role for Autologous Stem Cell Transplantation for the Treatment of Acute Myeloid Leukemia? Cancers (Basel). 2019 Dec 24;12(1):59.
- Montoto, S., Corradini, P., Dreyling, M., Ghielmini, M., Kimby, E., López-Guillermo, A., et al. Indications for hematopoietic stem cell transplantation in patients with follicular lymphoma: a consensus project of the EBMTLymphoma Working Party. Haematologica 2013; 98: 1014-11.
- Chen, J., Lazarus, H. M., Dahi, P. B., Avecilla, S., & Giralt, S. A. (2021). Getting blood out of a stone: Identification and management of patients with poor hematopoietic cell mobilization. Blood reviews, 47, 100771.
- Cowan, A. J., Stevenson, P. A., Cassaday, R. D., Graf, S. A., Fromm, J. R., Wu, D., et al. (2016). Pretransplantation Minimal Residual Disease Predicts Survival in Patients with Mantle Cell Lymphoma Undergoing Autologous Stem Cell Transplantation in Complete Remission. Biology of blood and marrow transplantation : journal of the American Society for Blood and Marrow Transplantation, 22(2), 380–385.
- Rossi, G., Falcone, A. P., Minervini, M. M., De Cillis, G. P., De Waure, C., Sisti, L. G., et al. (2019). Minimal residual disease and log-reduction of plasma cells are associated with superior response after double autologous stem cell transplant in younger patients with multiple myeloma. Cytometry. Part B, Clinical cytometry, 96(3), 195–200.
- Bochennek, K., Esser, R., Lehrnbecher, T., Glienke, W., Wehner, S., Erben, S., et al. (2012). Impact of minimal residual disease detection prior to autologous stem cell transplantation for post-transplant outcome in high risk neuroblastoma. Klinische Padiatrie, 224(3), 139–142.
- Tichopád, A., Vítová, V., Kořístek, Z., & Lysák, D. (2013). Cost-effectiveness of hematopoietic stem cell mobilization strategies including plerixafor in multiple myeloma and lymphoma patients. Journal of clinical apheresis, 28(6), 395–403.
- Miyamoto-Nagai, Y, Mimura, N, Tsukada, N, Aotsuka, N, Ri, M, Katsuoka, Y, et al. Outcomes of poor peripheral blood stem cell mobilizers with multiple myeloma at the first mobilization: A multicenter retrospective study in Japan. eJHaem. 2022; 3: 838– 848.
- Lorch, A., Bascoul-Mollevi, C., Kramar, A., Einhorn, L., Necchi, A., Massard, C., et al. (2011). Conventional-dose versus high-dose chemotherapy as first salvage treatment in male patients with metastatic germ cell tumors: evidence from a large international database. Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 29(16), 2178–2184.
- Ladenstein, R., Pötschger, U., Le Deley, M. C., Whelan, J., Paulussen, M., Oberlin, O., et al. (2010). Primary disseminated multifocal Ewing sarcoma: results of the Euro-EWING 99 trial. Journal of clinical oncology : official journal of the American Society of Clinical Oncology, 28(20), 3284–3291.
- Yalçin, B., Kremer, L. C., Caron, H. N., & van Dalen, E. C. (2013). High-dose chemotherapy and autologous haematopoietic stem cell rescue for children with high-risk neuroblastoma. The Cochrane database of systematic reviews, (8), CD006301.
- Miller, A. E., Chitnis, T., Cohen, B. A., Costello, K., Sicotte, N. L., Stacom, R., & National Medical Advisory Committee of the National Multiple Sclerosis Society (2021). Autologous Hematopoietic Stem Cell Transplant in Multiple Sclerosis: Recommendations of the National Multiple Sclerosis Society. JAMA neurology, 78(2), 241–246.
- Levin, D., Osman, M. S., Durand, C., Kim, H., Hemmati, I., Jamani, K., et al. (2022). Hematopoietic Cell Transplantation for Systemic Sclerosis-A Review. Cells, 11(23), 3912.
- Alegre, A., Tomás, J. F., Martínez-Chamorro, C., Gil-Fernández, J. J., Fernández-Villalta, M. J., Arranz, R., et al. (1997). Comparison of peripheral blood progenitor cell mobilization in patients with multiple myeloma: high-dose cyclophosphamide plus GM-CSF vs G-CSF alone. Bone marrow transplantation, 20(3), 211–217.
MAT-ES-2301008 V1 – Abril 2023
