- Artículo
- Fuente: Campus Sanofi
- 22 dic 2023
Retos en EICRc pulmonar

La afectación pulmonar es una de las formas más graves de EICRc. El diagnóstico precoz requiere monitorización de función pulmonar cada 3-6 meses durante los 2 primeros años post-TPH. La mala respuesta a los tratamientos de 1ª y 2ª líneas disponibles justifica la utilización de nuevos agentes con actividad antifibrótica y/o tratamiento combinado dentro de un ensayo clínico.
Aunque su frecuencia es escasa (3-11%), la EICRc pulmonar sigue teniendo un pronóstico muy adverso1-3. El cuadro clínico característico es el síndrome de bronquiolitis obliterante (BOS)4 que suele tener un desarrollo lentamente progresivo, inicialmente con disnea leve de esfuerzo y/o tos seca con auscultación pulmonar y Rx tórax normales. Simula o facilita infecciones de vías respiratorias altas, por lo que es importante tener un alto nivel de sospecha. El diagnóstico se basa en la disminución obstructiva de la función pulmonar en ausencia de otras etiologías. Por este motivo se realiza monitorización con pruebas funcionales respiratorias (PFR) que incluyen espirometría y test de difusión de CO, pre-TPH y cada 3-6 meses durante los primeros 2 años.
Hasta hace unos años la biopsia pulmonar era el método considerado óptimo de diagnóstico. El grupo de consenso del NIH 2014 considera que los criterios de estudios de función pulmonar (PFR) son suficientes5 si se asocian a otras manifestaciones de EICRc (>75% de los casos), evitando así la morbilidad asociada a la biopsia.
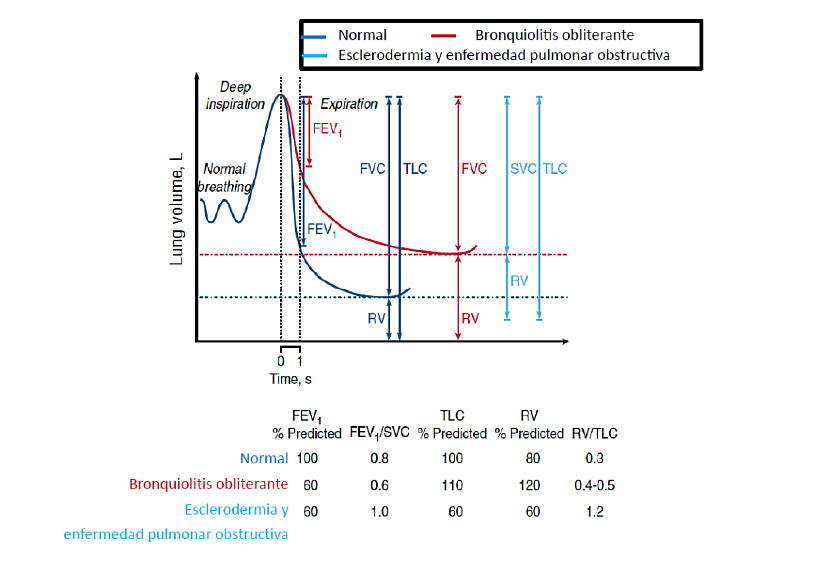
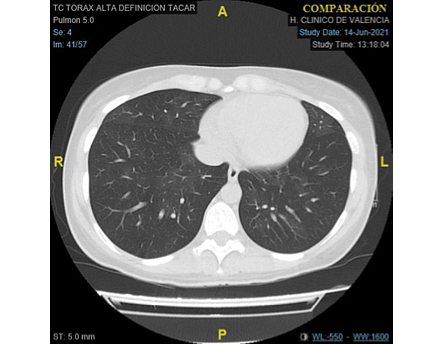
Los criterios en PFR son: 1. FEV1<75% previsto, con una disminución de ≥10% en menos de 2 años, 2. Relación FEV1/FVC inferior a 0,7 o el límite inferior del intervalo de confianza del 90% de esta relación (Figura 1), 3. Ausencia de infección y 4. Cualquiera de los siguientes: a. diagnóstico previo de EICRc, b. Atrapamiento aéreo en la TAC en espiración o engrosamiento de vías respiratorias pequeñas o bronquiectasias en TAC-AR (Figura 2) c. Atrapamiento aéreo en PFR: volumen residual (RV) superior al 120% o RV / capacidad pulmonar total (TLC) superior al intervalo de confianza del 90%.
Figura 1: Espirometría: valores curvas flujo-volumen normal, BOS y en cuadro de esclerodermia o enfermedad pulmonar obstructiva crónico
.jpg)
Figura 2: TAC-AR en paciente con BOS en fase inicial
Tras el diagnóstico de EICRc y la gradación, en caso de ser moderada o grave (puntuación pulmonar ≥1) las opciones de tratamiento son6,7:
a) Corticoides sistémicos (1 mg/kg/día) con eficacia mantenida limitada (<30%), especialmente en la afectación pulmonar (<20%).
b) Corticoides sistémicos (1 mg/Kg/día) asociados a inhibidores de calcineurina u otro inmunosupresor. La adición de otro IS, incluyendo azatioprina, ciclosporina, talidomida, MMF, hidroxicloroquina, sirolimus, ECP o Ibrutinib) al tratamiento de primera línea con corticoides no ha demostrado beneficio significativo en EICRc. Sin embargo, se utiliza en: EICRc grave o en formas moderadas con factores de alto riesgo como trombopenia (< 100 x109/L), bilirrubina elevada o progresión intra-tratamiento con corticoides.
c) Participación en ensayo clínico. Al tratamiento inmunosupresor, se debe asociar tratamiento de soporte con profilaxis antimicrobiana y, en el caso de afectación pulmonar, la triple terapia con Fluticasona inhalada, Azitromicina, Montelukast (FAM)5
En caso de refractariedad a corticoides, se pueden usar varias terapias sistémicas de segunda o posteriores líneas, aunque a excepción de ruxolitinib, ninguna de estas terapias tiene evidencia en ensayos aleatorizados9-11. La eficacia de estos agentes es muy limitada en la EICRc pulmonar, con tasas de respuesta inferiores al 15-20-% y necesidad de múltiples terapias secuenciales o combinadas.
La inhibición de ROCK (Rho-associated coiled-coil-containing protein kinase) parece mejorar la fibrosis pulmonar al actuar sobre macrófagos intersticiales12. El belumosudil, un inhibidor oral selectivo de ROCK2, ha sido aprobado recientemente por la FDA en el tratamiento de la EICRc refractaria a ≥2 líneas. Las respuestas pulmonares observadas en el estudio fase 2 ROCKstar fueron del 26%.13.
Así mismo, se han utilizado agentes antifibróticos (pirfenidona y nintedanib) que han demostrado estabilización de la función pulmonar en casos de fibrosis pulmonar idiopática y se han utilizado en series limitadas de casos de BOS tras TPH-Alo14,15. Estos agentes se están evaluando en ensayos clínicos controlados y aleatorizados que analizan el cambio en el FEV1 tras 6 meses de tratamiento antifibrótico, para el tratamiento del SBO tras trasplante pulmonar (estudio EPOS con pirfenidona, NCT02262299, y estudio INFINITx-BOS con nintedanib, NCT03283007), que pueden aportar evidencia para su uso en BOS post-TPH.
Autor

Carlos Solano Vercet
Servicio de Hematología y Hemoterapia
Hospital Clínico Universitario-INCLIVA. Valencia.

Referencias
- Arora M, Cutler CS, Jagasia MH, Pidala J, Chai X, Martin PJ et al. Late Acute and Chronic Graft-versus-Host Disease after Allogeneic Hematopoietic Cell Transplantation. Biol Blood Marrow Transplant 2016;22:449-55
- Bergeron A, Chevret S, Peffault de Latour R, Chagnon , Margerie-Mellon C et al. Noninfectious lung complications after allogeneic haematopoietic stem cell transplantation. Eur Respir J. 2018;51(5):1702617
- Kwok C, Liang BM, Lui MMS, Tam TCC, Sim JPY, Tse EWC et al. Rapid versus gradual lung function decline in bronchiolitis obliterans syndrome after haematopoietic stem cell transplantation is associated with survival outcome. Respirology 2019 May;24(5):459-466.
- Jagasia MH, Greinix HT, Arora M, Williams KM, Wolff D, Cowen EW, et al. National Institutes of Health consensus development project on criteria for clinical trials in chronic graft-versus-host disease: I. The 2014 Diagnosis and Staging Working Group Report. Biol Blood Marrow Transplant. 2015;21:389–401.
- Williams KM. How I treat bronchiolitis obliterans syndrome after hematopoietic stem cell transplantation Blood 2017;129:448-455
- Flowers MED, Martin PJ. How we treat chronic graft-versus-host disease. Blood 2015;125:606-615
- Lee SJ, Flowers MED. Recognizing and managing chronic graft-versus-host disease. Hematology Am Soc Hematol Educ Program. 2008:134-41.
- Koc S, Leisenring W, Flowers MED, Anasetti C, Deeg HJ, Nash RA, et al. Therapy for chronic graft-versus-host disease: A randomized trial comparing cyclosporine plus prednisone versus prednisone alone. Blood 2002;100:48-51.
- Penack O et al. Lancet Haematol 2020;7:157-67
- Sarantopoulos S, Cardones AR, Sullivan KM. How I treat refractory chronic graft-versus-host disease. Blood. 2019;133(11):1191-1200
- Zeiser R, Polverelli N, Ram R , Hashmi SK, Chakraverty R, Middeke JMet al. Ruxolitinib for Glucocorticoid-Refractory Chronic Graft-versus-Host Disease. N Engl J Med 2021;385:228-38.
- Riches DWH, Backos DS, Redente EF: ROCK and rho: Promising therapeutic targets to ameliorate pulmonary fibrosis. Am J Pathol 185:909-912, 2015
- Cutler C, Lee SJ, Arai S, et al. Belumosudil for chronic graft-versus-host disease after 2 or more prior lines of therapy: the ROCKstar Study. Blood. 2022 Mar 17;139(11):1772
- Hostettler Haack KE, Halter J, Tamm M. Pirfenidone treatment in patients with bronchiolitis obliterans syndrome following allogeneic hematopoietic stem cell transplantation. Eur Respir J 2016; 48: Suppl. 60,PA3923.
- Tang W, Yu T , Dong T , Liu T, Ji j. Nintedanib in Bronchiolitis Obliterans Syndrome After Allogeneic Hematopoietic Stem Cell Transplantation Chest. 2020 Sep;158(3):e89-e91
MAT-ES-2300927 V1 - Abril 2023
