- Artículo
- Fuente: Campus Sanofi
- 24 feb 2023
Terapia CAR-T vs. autotrasplante en la segunda línia de tratamiento del linfoma B agresivo

¿Desbancará la terapia CAR-T el auto trasplante en la segunda línea de tratamiento del linfoma B agresivo?
La terapia de células T con receptores quiméricos de antígenos (CAR-T, chimeric antigen receptor T-cell) constituye un cambio de paradigma en el tratamiento de los linfomas B agresivos recaídos o refractarios, actualmente aprobada a partir de la tercera línea. En este artículo, comentaré los datos mediante los cuales esta terapia intenta adelantar su indicación a la segunda línea, y destronar así al trasplante autólogo, estándar de tratamiento mundialmente consolidado hasta el momento actual.
Actualmente, en los linfomas B agresivos, como el linfoma B difuso de células grandes y el linfoma B de alto grado, un 35-40% de los pacientes necesitarán tratamiento de rescate1. El trasplante autólogo de progenitores hematopoyéticos (auto-TPH) es la terapia de elección en aquellos pacientes que, por sus comorbilidades y su edad, puedan tolerarlo, que son en torno al 50%. Sin embargo, solo en el 40% habrá al menos una respuesta parcial como para poder finalmente realizar el trasplante, y después de hacerlo, la mitad recaerán. Por tanto, con esta estrategia, solo conseguimos curar un 10% de los pacientes recaídos/refractarios2. La supervivencia en no candidatos o en recaídos después del auto-THP era nefasta3,4. La terapia CAR-T anti-CD19 ha cambiado el paradigma de tratamiento de este grupo de pacientes, consiguiendo en tercera línea remisiones duraderas en cerca del 40% de los pacientes5-7. Tres CAR-T están aprobados en Estados Unidos: axicabtagene-ciloleucel (axi-cel), tisagene-lecleucel (tisa-cel) y lisocabtagene-maraleucel (liso-cel), los dos primeros también en Europa. Con este antecedente, se ha buscado anticipar la utilización de esta terapia a la primera recaída comparándola con el auto-TPH.
Recientemente se han comunicado tres estudios fase III que buscan este objetivo, con diferencias en sus diseños (Tabla 1) y en sus resultados (Tabla 2). En el ensayo ZUMA-78, se comparó axi-cel (180 pacientes) frente a auto-TPH (179 pacientes), obteniendo mayor tasa de respuesta completa (65% frente a 32%) y mayor supervivencia libre de evento para la rama CAR-T (cociente de riesgo o hazard ratio [HR] para evento o muerte: 0,40; p <0,001). Asimismo, el estudio TRANSFORM9 evaluó liso-cel (92 pacientes) frente a auto-TPH (92 pacientes), resultando el primero también con mejores tasas de respuesta completa (66% frente a 39%) y mejor supervivencia libre de evento (HR para evento o muerte: 0,34; p <0,001). Sin embargo, el estudio BELINDA10 comparó tisa-cel (162 pacientes) con auto-TPH (160 pacientes), sin observarse diferencias significativas en las tasas de respuesta o supervivencia (HR de evento o muerte: 1,07; p = 0,69).
Tabla 1. Características del diseño los ensayos clínicos fase III que comparan terapia CAR-T vs Autotrasplante
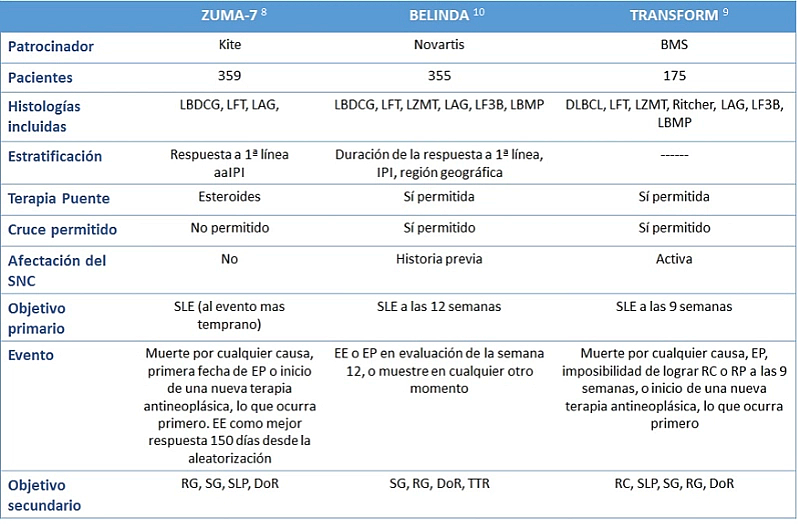
aaIPI: índice pronóstico internacional ajustado a la edad; DoR: duración de la respuesta (duration of response); EE: enfermedad estable; EP: enfermedad progresiva; FLT: linfoma folicular transformado; IPI: índice pronóstico internacional; LAG: linfoma de alto grado; LBDCG: linfoma B difuso de células grandes; LBPM: linfoma B primario mediastínico; LF3B: linfoma folicular 3B; LZMT: linfoma de la zona marginal transformado; RP: respuesta parcial RC: respuesta completa; RG: respuesta global; SG: supervivencia global; SLE: supervivencia libre de evento; SLP: supervivencia libre de progresión; SNC: sistema nervioso central; TTR: tiempo hasta la próxima terapia.
Tabla 2. Resultados de los ensayos clínicos fase III que comparan terapia CAR-T vs Auto-trasplante*
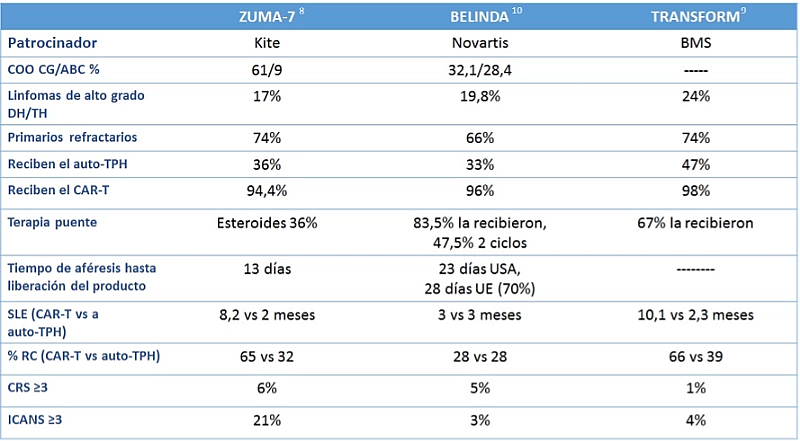
*Por diferencias en el diseño de los estudios, las características basales y otros factores, no se deben comparar los datos de los estudios clínicos presentados
ABC: activated B ophenotype (fenotipo B activado); auto-THP: trasplante autólogo de progenitores hematopoyéticos; CAR-T: células T con receptores quiméricos de antígenos; CG: centrogerminal; COO: célula de origen (cells of origin); CRS: síndrome de liberación de citocinas; DH: double hit; ICANS: síndrome de neurotoxicidad asociado a células efectoras inmunitarias; RC: respuesta completa; SLE: supervivencia libre de evento; TH: triple hit.
¿Qué puede justificar estas diferencias entre los estudios?
Indudablemente, los malos resultados del estudio BELINDA sorprenden. El diferente diseño de estos estudios podría justificar en parte los datos. En este sentido, la prohibición de la terapia puente diferente al esteroide en el ZUMA-7 pudo contribuir a seleccionar un mejor perfil de pacientes, ya que conocemos estudios previos en que la necesidad de terapia puente se asocia con un detrimento para la supervivencia, y es una realidad que el paciente con una enfermedad rápidamente progresiva, que no aguanta sin terapia puente, no está incluido en este estudio. Por otra parte, la logística también parece un punto clave, con medianas de tiempo entre aféresis e infusión que se duplican en el estudio BELINDA respecto al ZUMA-7. También es importante tener en cuenta la definición de evento, ya que el BELINDA permitió dos diferentes regímenes de inducción previo al auto-TPH, sucediendo en uno de cada tres pacientes, mientras que en el ZUMA-7 esto se hubiera considerado evento.
¿Cuál será el próximo estándar de tratamiento en la primera recaída?
Ninguno de estos ensayos responden a si al paciente quimiosensible a la segunda línea es mejor llevarlo a terapia CAR-T o a auto-TPH. Sin embargo, datos retrospectivos recientes parecen mostrar que, en este contexto de quimiosensibilidad, el trasplante sigue teniendo su papel11. Asimismo, es importante tener en cuenta que los pacientes recaídos tras el año de la inducción tampoco han sido evaluados en estos estudios y, por tanto, quedan fuera del alcance de estas estrategias, al menos con los datos actuales. Ahora sí, en el linfoma refractario o que recae precozmente, la superioridad del CAR-T parece clara, y es aquí donde adelantar esta terapia parece beneficiar significativamente a nuestros pacientes. El coste de estas nuevas estrategias entrará indudablemente en la ecuación cuando se vaya a definir el perfil del candidato a terapia CAR-T en la primera recaída.
Autora

Dra. Mariana Bastos Oreiro
Servicio de Hematología.
Hospital General Universitario Gregorio Marañón. Madrid

Referencias
- Sehn LH, Salles G. Diffuse Large B-Cell Lymphoma. N Engl J Med. 2021;384(9):842-58.
- Gisselbrecht C, Glass B, Mounier N, Singh Gill D, Linch DC, Trneny M, et al. Salvage regimens with autologous transplantation for relapsed large B-cell lymphoma in the rituximab era. J Clin Oncol. 2010;28(27):4184-90.
- Crump M, Neelapu SS, Farooq U, Van Den Neste E, Kuruvilla J, Westin J, et al. Outcomes in refractory diffuse large B-cell lymphoma: results from the international SCHOLAR-1 study. Blood. 2017;130(16):1800-8.
- Glass B, Dohm AJ, Truemper LH, Pfreundschuh M, Bleckmann A, Wulf GG, et al. Refractory or relapsed aggressive B-cell lymphoma failing (R)-CHOP: an analysis of patients treated on the RICOVER-60 trial. Ann Oncol. 2017;28(12):3058-64.
- Neelapu SS, Locke FL, Bartlett NL, Lekakis LJ, Miklos DB, Jacobson CA, et al. Axicabtagene Ciloleucel CAR T-Cell Therapy in Refractory Large B-Cell Lymphoma. N Engl J Med. 2017;377(26):2531-44.
- Schuster SJ, Bishop MR, Tam CS, Waller EK, Borchmann P, McGuirk JP, et al. Tisagenlecleucel in Adult Relapsed or Refractory Diffuse Large B-Cell Lymphoma. N Engl J Med. 2019;380(1):45-56.
- Abramson JS, Palomba ML, Gordon LI, Lunning MA, Wang M, Arnason J, et al. Lisocabtagene maraleucel for patients with relapsed or refractory large B-cell lymphomas (TRANSCEND NHL 001): a multicentre seamless design study. Lancet. 2020;396(10254):839-52.
- Locke FL, Miklos DB, Jacobson CA, Perales M-A, Kersten M-J, Oluwole OO, et al. Axicabtagene Ciloleucel as Second-Line Therapy for Large B-Cell Lymphoma. N Engl J Med. 11 Dic 2021. [Online antes de impresión].
- Kamdar M. Lisocabtagene Maraleucel (liso-cel), a CD19-Directed Chimeric Antigen Receptor (CAR) T Cell Therapy, Versus Standard of Care (SOC) with Salvage Chemotherapy (CT) Followed By Autologous Stem Cell Transplantation (ASCT) As Second-Line (2L) Treatment in Patients (Pts) with Relapsed or Refractory (R/R) Large B-Cell Lymphoma (LBCL): Results from the Randomized Phase 3 Transform Study. [Internet]. En: ASH Annual Meeting and Exposition 2021. American Society of Hematology; 2021. [Citado 14 Ene 2022]. Disponible en: https://ash.confex.com/ash/2021/webprogram/Paper147913.html
- Bishop MR, Dickinson M, Purtill D, Barba P, Santoro A, Hamad N, et al. Second-Line Tisagenlecleucel or Standard Care in Aggressive B-Cell Lymphoma. N Engl J Med. 14 Dic 2021. [Online antes de impresión].
- Shadman M, Pasquini MC, Ahn KW, Chen Y, Turtle CJ, Hematti P, et al. Autologous Transplant versus Chimeric Antigen Receptor T-cell Therapy for Relapsed DLBCL in Partial Remission. Blood. 27 Sep 2021;blood.2021013289. [Online antes de impresión].
MAT-ES-2202657 V1 – Septiembre 2022
