- Artículo
- Fuente: Campus Sanofi
- 24 abr 2024
Timoglobulina en receptores de TR de riesgo inmunológico medio-bajo: mi experiencia

Introducción
El uso de rATG en enfermos de riesgo inmunológico medio-bajo está en debate, dada su potencia, que reduce la tasa de rechazo, pero incrementa las complicaciones infecciosas y neoplásicas. Ciertas poblaciones, como receptores mayores de 65 años, de donantes en asistolia controlada o de donantes con criterios expandidos, podrían beneficiarse de su uso con una monitorización estricta. Describimos nuestra experiencia con esta estrategia en dicha población.
Las guías KDIGO recomiendan el uso universal de inducción en trasplante renal (1A) aunque el tipo de agente en inducción está menos definido, siendo los enfermos de alto riesgo inmunológico tributarios a recibir rATG en vez de anticuerpos anti-CD25 (2B)1.
Pero el uso de rATG en enfermos de riesgo inmunológico medio-bajo está en debate, dada su potencia, que reduce la tasa de rechazo2 pero incrementa las complicaciones infecciosas y neoplásicas3.
Ciertas poblaciones, como receptores mayores de 65 años, de donantes en asistolia controlada o de donantes con criterios expandidos, podrían beneficiarse de su uso desde un punto de vista teórico, ya que su empleo permitiría la introducción retrasada de Tacrolimus2, cuyo efecto nefrotóxico indiscutible4 se añadiría al efecto isquémico del síndrome de isquemia-reperfusión5, que se incrementa en el trasplante realizado bajo las mencionadas condiciones.
Dichas características actualmente se observan en un importante porcentaje de trasplantes en España según la ONT6. En concreto al menos una de ellas estaba presente en 57 de los 79 receptores trasplantados en nuestro hospital en 2023 (72,1%).
El uso de rATG en estas poblaciones debe controlarse estrictamente para evitar las complicaciones derivadas del uso de este potente inmunosupresor3,7. La monitorización del efecto de la rATG se realiza mediante el computo de la dosis acumulada en mg/kg, controlando la administración de dosis por contaje de linfocitos totales o de linfocitos T8,9, demostrándose la superioridad de este último método, que permite la reducción de la dosis administrada sin reducción de eficacia8-10.
Hemos realizado en nuestra Unidad inducción con rATG en esta población desde el 2017, controlada mediante la determinación de linfocitos T, con introducción retrasada de tacrolimus cuando la función renal mejora (creatinina sérica 3,5 mg/dL), sin evidenciar en ningún caso su complicación tumoral más grave, la enfermedad proliferativa difusa post-trasplante7. El contaje de linfocitos T se efectuó mediante citometría de flujo con anticuerpos monoclonales (Caltag) con citómetro de Facsort (Beckton Dickinson)10. El dintel para omitir dosis fue menos de 10 linfocitos T/µL8,10, ya que la funcionalidad de ese contaje oscilaba entre 225 y 382 ng/mL de ATP, cifras intermedias de los riesgos relativos de infección o de rechazo11.
En cuanto a la infección por CMV, el uso de rATG incrementa su frecuencia3,12. Su incidencia en nuestros pacientes, con un protocolo de tratamiento preventivo y considerando infección en seropositivos la presencia de más de 1000 UI/mL13, ha sido del 8,3%, el 6,8% si excluimos los 6 casos que la desarrollaron recibiendo Micofenolato de mofetilo por contraindicación del uso de Sirolimus, tras cambiar en la pauta de inmunosupresión en 2018, Micofenolato Mofetilo por Sirolimus, dados los datos de reducción de dicha infección con el uso de inhibidores m-TOR objetivada en amplios estudios como el TRANSFORM14.
En este periodo nuestra incidencia de retraso en la función renal, definida como necesidad de diálisis, ha sido del 12,3%.
En el paciente de 72 Kg cuya evolución se describe en la figura 1, administramos la primera dosis de 75 mg de rATG en el quirófano, junto con Sirolimus y prednisona, y repetimos dosis el primer día. Posteriormente evaluamos su efecto con el contaje de linfocitos T, en este caso 25 linfocitos T/µL, por lo que administramos dosis y no Tacrolimus, por presentar una creatinina sérica de 5,2 mg/dL. Iniciamos Tacrolimus al día siguiente, ya que la creatinina sérica descendió a 3,1 mg/dL y administramos la dosis de rATG al objetivar 14 linfocitos T/µL. Al cuarto día, el contaje había caído a 8 linfocitos T/µL, por lo que no se administró dosis, ni en los días sucesivos, al tener un nivel valle adecuado de Tacrolimus tras 48h de su inicio, aunque el contaje de linfocitos T era 19 linfocitos T/µL.
Figura 1. Evolución de receptor de trasplante renal de bajo riesgo inmunológico con inducción con rATG e introducción retardada de tacrolimus.
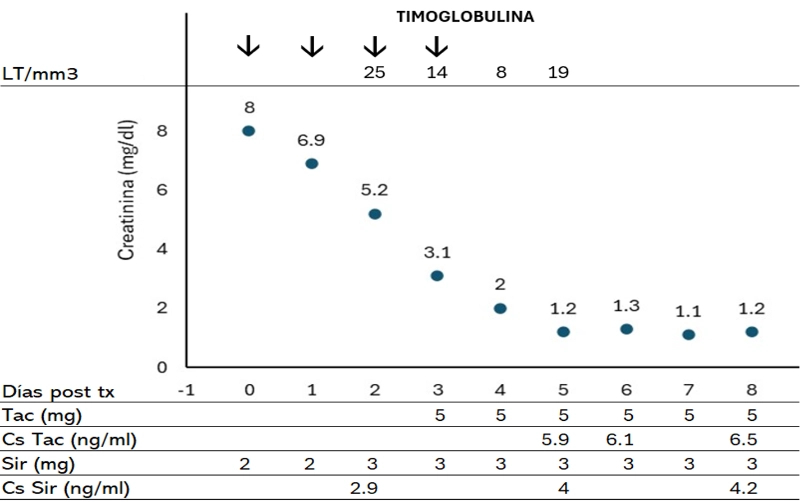
Tac: tacrolimus; Cs Tac: concentración sérica valle tacrolimus; Pos tx: post trasplante; Sir: sirolimus; Cs Sir: concentración sérica valle sirolimus; LT: Linfocitos T
Concluimos que el uso de nuestro régimen inmunosupresor con rATG en pacientes de bajo y medio riesgo inmunológico, con monitorización estricta de linfocitos T, introducción retrasada de Tacrolimus y uso de Sirolimus ha conducido a unos buenos resultados que confirman la base teórica de este tratamiento.
*(El rATG utilizado en el centro fue Timoglobulina)
Autor

Dr. Antonio Franco Esteve
Unidad de Trasplante renal. Hospital General Dr. Balmis. Alicante
Contenido mínimo de Timoglobulina®
PRESENTACIÓN, PRECIO Y CONDICIONES DE PRESCRIPCIÓN Y DISPENSACIÓN:
Envase con 1 vial de polvo (CN 800425.6): PVP notificado: 550,91 €. PVP IVA notificado: 572,95 €. Medicamento sujeto a prescripción médica. Uso hospitalario. Financiado por el SNS.

Referencias
- Eckardt K-U, Kasiske BL, Zeier MG. KDIGO clinical practice guideline for the care of kidney transplant recipients. Am J Transplant [Internet]. Am J Transplant; 2009 Nov [cited 2024 Feb 2];9 Suppl 3:S1–155. Available from: https://pubmed.ncbi.nlm.nih.gov/19845597/
- Asderakis A, Sabah TK, Watkins WJ, Khalid U, Szabo L, Stephens MR, et al. Thymoglobulin Versus Alemtuzumab Versus Basiliximab Kidney Transplantation From Donors After Circulatory Death. Kidney Int reports [Internet]. Kidney Int Rep; 2022 Apr 1 [cited 2024 Feb 2];7(4):732–40. Available from: https://pubmed.ncbi.nlm.nih.gov/35497810/
- Romao EA, Yamamoto AY, Gaspar GG, Garcia TMP, Muglia VA, Nardin MEP, et al. Significant Increase in Cytomegalovirus (CMV) Infection in Solid Organ Transplants Associated With Increased Use of Thymoglobulin as Induction Therapy? Transplant Proc [Internet]. Transplant Proc; 2023 Nov 1 [cited 2024 Feb 2];55(9):2035–40. Available from: https://pubmed.ncbi.nlm.nih.gov/37778934/
- Farouk SS, Rein JL. The Many Faces of Calcineurin Inhibitor Toxicity-What the FK? Adv Chronic Kidney Dis [Internet]. Adv Chronic Kidney Dis; 2020 Jan 1 [cited 2024 Feb 2];27(1):56–66. Available from: https://pubmed.ncbi.nlm.nih.gov/32147003/
- Ponticelli C. Ischaemia-reperfusion injury: a major protagonist in kidney transplantation. Nephrol Dial Transplant [Internet]. Nephrol Dial Transplant; 2014 [cited 2024 Feb 2];29(6):1134–40. Available from: https://pubmed.ncbi.nlm.nih.gov/24335382/
- Organización Nacional de Trasplantes (España). ACTIVIDAD DE DONACIÓN Y TRASPLANTE ESPAÑA 2022 Organización Nacional de Trasplantes. 2022.
- Franco A, Hernández D, Más-Serrano P, Zarraga S, Sanchez A, Crespo M, et al. Incidence of Lymphoproliferative Disorders After Renal Transplantation is Down, but the Poor Prognosis Remains. Multicenter 32-Year Cohort Study. Transplant Proc [Internet]. Transplant Proc; 2022 Nov 1 [cited 2024 Feb 2];54(9):2462–6. Available from: https://pubmed.ncbi.nlm.nih.gov/36379722/
- Djamali A, Turc-Baron C, Portales P, Leverson G, Chong G, Clot J, et al. Low dose antithymocyte globulins in renal transplantation: daily versus intermittent administration based on T-cell monitoring. Transplantation [Internet]. Transplantation; 2000 Mar 15 [cited 2024 Feb 2];69(5):799–805. Available from: https://pubmed.ncbi.nlm.nih.gov/10755529/
- Buchler M, Thybault G, Al Najjar A, Valentín JF, Guerraoui A, Nivet H, Bardos P LY. Monitoring of ATG therapy by flow cytometry and lymphocyte counts in renal transplantation. Transpl Proc [Internet]. 1996 [cited 2024 Feb 5];28(5):2817–8. Available from: https://pubmed.ncbi.nlm.nih.gov/8908076/
- Franco A, Alvárez L, Gimeno A, Sen ML, Muñoz C, Sánchez-Paya J, et al. Study of the correlation between two methods used to monitor thymoglobulin therapy in renal transplantation. Transplant Proc. Elsevier Inc.; 2003;35(5):1778–9.
- Kowalski RJ, Post DR, Mannon RB, Sebastian A, Wright HI, Sigle G, et al. Assessing relative risks of infection and rejection: a meta-analysis using an immune function assay. Transplantation [Internet]. Transplantation; 2006 Sep [cited 2024 Feb 2];82(5):663–8. Available from: https://pubmed.ncbi.nlm.nih.gov/16969290/
- Montero N, Rodrigo E, Crespo M, Cruzado JM, Gutierrez-Dalmau A, Mazuecos A, et al. The use of lymphocyte-depleting antibodies in specific populations of kidney transplant recipients: A systematic review and meta-analysis. Transplant Rev (Orlando) [Internet]. Transplant Rev (Orlando); 2023 Dec 1 [cited 2024 Feb 2];37(4). Available from: https://pubmed.ncbi.nlm.nih.gov/37774445/
- Gómez-Marqués G, Alonso A, Bayés B, Bernal G, Fernández AM, Franco A, et al. Diagnóstico de la infección por citomegalovirus. Nefrología [Internet]. 2012;3(1):14–20. Available from: https://www.revistanefrologia.com/es-diagnostico-infeccion-por-citomegalovirus-articulo-X2013757512000650
- Tedesco-Silva H, Pascual J, Viklicky O, Basic-Jukic N, Cassuto E, Kim DY, et al. Safety of everolimus with reduced calcineurin inhibitor exposure in de novo kidney transplants: An analysis from the randomized transform study. Transplantation [Internet]. Lippincott Williams and Wilkins; 2019 Sep 1 [cited 2024 Feb 2];103(9):1953–63. Available from: https://journals.lww.com/transplantjournal/fulltext/2019/09000/safety_of_everolimus_with_reduced_calcineurin.36.aspx
MAT-ES-2400366 V2 Febrero 2026

.jpg)