- Artículo
- Fuente: Campus Sanofi
- 18 feb 2024
Trasplante renal de donante en asistolia controlada
El uso de donantes en asistolia controlada se ha ido expandiendo, tanto en número como en edad y complejidad, representando un porcentaje alto del total de los donantes y de los trasplantes que se realizan en nuestro país. Se revisan brevemente sus resultados y las variables que influyen en su evolución.
Beneficio de expandir el pool de donantes utilizando riñones de donación en asistolia controlada (DAC)
El aumento en el número de pacientes en lista de espera de un trasplante renal ha hecho que se haya ido considerando aumentar el número de potenciales donantes aceptando riñones que previamente no se consideraban óptimos para el trasplante. Entre estos se encuentran la utilización de riñones de donantes con criterios expandidos (DCE), definidos en función de su edad y de otras características como la creatinina final, la hipertensión o el fallecimiento por accidente cerebrovascular, de donantes con fracaso renal agudo o de donantes de asistolia 1,2.
La utilización de estos últimos, principalmente de donantes en asistólica controlada (DAC) tipo III de Maastricht se ha ido incrementando en los últimos años en distintos países. Así, en Reino Unido, el porcentaje de donantes en asistolia se multiplicó por seis entre 2004 y 2013, en Holanda un 43% de los trasplantes renales realizados entre 2000 y 2017 procedían de DAC y en España la DAC llegó a representar un 42% de los donantes de trasplante renal de donantes fallecidos en 2022 3-5. El uso de injertos renales de DAC ha demostrado mejorar la supervivencia de los pacientes más que si continuaban en la lista de espera, acortando los tiempos para recibir un trasplante, contribuyendo así a expandir el “pool” de potenciales donantes y a reducir el crecimiento de la lista de espera 4,6-10.
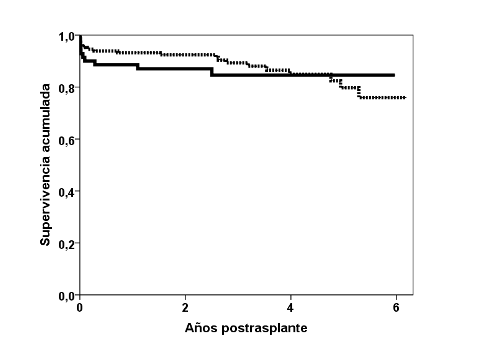
El hecho de que los injertos renales obtenidos de DAC hayan sufrido un tiempo de parada circulatoria hace que puedan haber sufrido un daño isquémico variable que comprometan sus resultados. Sin embargo, aunque la mayoría de los estudios han detectado que estos riñones sufren más función retrasada del injerto y más “no función primaria”, los resultados en cuanto a la supervivencia del injerto renal y del paciente son similares a los obtenidos con trasplante de muerte encefálica (DME) (Figura 1) 4,8. Además, los resultados han ido mejorando a lo largo de los años por la mayor experiencia en su manejo y en la selección de los donantes 11. Esta mayor experiencia ha ido haciendo que cada vez se utilicen más injertos de DAC con criterios expandidos, con resultados similares a los de DME/DCE 12, 13. El uso de injertos de DAC/DCE o de DAC de donantes mayores de 60 años mejora la supervivencia respecto a seguir en la lista de espera 6,14. El estudio GEODAS ha demostrado que la supervivencia, censurando por fallecimiento, del trasplante renal de DAC >65 años es equivalente a los de DME 15, aunque no se ha confirmado que la supervivencia del receptor sea mejor que si continuaba en la lista de espera 16.
Figura 1. Supervivencia de los injertos renales obtenidos mediante DAC (línea continua) versus DME (línea discontinua) en el Hospital Universitario Marqués de Valdecilla.
Variables que influyen en los resultados de los trasplantes de DAC (Tabla 1)
La calidad del donante tiene una mayor influencia en los resultados del trasplante que el tipo de donación (DAC versus DME). Entre las características del donante que influyen están la historia de hipertensión, de diabetes, los antecedentes cardiovasculares, la disfunción renal y, fundamentalmente, la edad, que es la variable que influye más en los resultados de la DAC8, 9, 14,17-19.
Como se comentó previamente, cada vez se han utilizado injertos de DAC de mayor edad, con beneficio demostrado en la supervivencia del receptor por lo menos hasta los 65 años 16. Tras la edad, la variable de mayor influencia es la isquemia fría, siendo, además, una variable modificable. Se ha demostrado que la disminución de la isquemia fría ha contribuido a mejorar los resultados de los injertos de DAC/DCE 11. De forma similar, recientemente se ha observado que una reducción de los tiempos quirúrgicos puede mejorar los resultados en este tipo de trasplantes, siempre más sensibles al daño isquémico. Entre estos, parece de interés intentar reducir el tiempo de extracción, definido como el intervalo entre el inicio del clampaje y la colocación del riñón donado en hielo 19, 20. Ni los parámetros de perfusión en la máquina, ni los resultados de la biopsia, ni las escalas de valoración de riesgo del donante se han demostrado útiles para valorar la viabilidad de los órganos obtenido mediante DAC 19.
Tabla 1. Variables que influyen en los resultados de los trasplantes de DAC (donación asistolia controlada)
- Donantes con criterios expandidos
- Edad del donante
- Función renal
- Hipertensión arterial
- Fallecimiento por ACVA
- Donante diabético
- Tiempo en diálisis
- Eventos CV receptor
- Isquemia fría
- Tiempos quirúrgicos
- Perfusión regional normotérmica
- Máquina de perfusión
¿Podemos mejorar los resultados de los trasplantes de DAC?
Además, de reducir la isquemia fría y el daño isquémico relacionado con los tiempos quirúrgicos, se han considerado otros procedimientos para mejorar los resultados de los injertos de DAC. El uso de perfusión regional normotérmica con ECMO en el donante ha demostrado mejores resultados (menor función retrasada del injerto y mayor función renal al primer año) y un aprovechamiento de un mayor número de órganos que la extracción super-rápida 21,22.
Para el mantenimiento del riñón tras la extracción, el uso de máquina de perfusión, además de permitir estimar la viabilidad del órgano, reduce la incidencia de función retrasada del injerto, aunque no mejora la supervivencia del injerto a largo plazo 23. De forma importante, respecto de la inmunosupresión, se sabe que se debe usar inducción en todos los receptores de DAC, ya que permite limitar la exposición a anticalcineurínicos. Aunque no hay unas recomendaciones específicas sobre el tipo de inducción y muchos centros utilizan basiliximab en DAC 19 se sabe que el uso de agentes antilinfocitarios protege de la función retrasada del injerto y disminuye la incidencia de rechazo agudo en estos pacientes 24. Un estudio prospectivo recientemente llevado a cabo específicamente en receptores de DAC ha demostrado mayor supervivencia del paciente, del injerto y menor tasa de rechazo agudo en los pacientes tratados con timoglobulina que en los que recibían inducción con basiliximab 25.
Conclusión
El uso de injertos de donación en asistolia controlada ha aumentado, incrementándose la edad y las comorbilidades asociadas aceptadas, obteniendo buenos resultados de supervivencia que confirman la utilidad de esta estrategia. La reducción de la isquemia fría y de los tiempos quirúrgicos, el uso de perfusión regional normotérmica y de la máquina de perfusión y un manejo de la inmunosupresión adecuado contribuyen a mejorar sus resultados.
Autor

Dr. Emilio Rodrigo Calabia
Jefe de Sección de Nefrología, Hospital Universitario Marqués de Valdecilla, Santander

Referencias
- Heilman RL, Mathur A, Smith ML, Kaplan B, Reddy KS. Increasing the Use of Kidneys from Unconventional and High-Risk Deceased Donors. Am J Transplant. 2016; 16: 3086–3092.
- Port FK, Bragg-Gresham JL, Metzger RA, Dykstra DM, Gillespie BW, Young EW, et al. Donor characteristics associated with reduced graft survival: an approach to expanding the pool of kidney donors. Transplantation 2002; 74: 1281–1286.
- Summers DM, Watson CJ, Pettigrew GJ, Johnson RJ, Collett D, Neuberger JM, et al. Kidney donation after circulatory death (DCD): state of the art. Kidney Int 2015; 88: 241–249.
- Schaapherder A, Wijermars LGM, de Vries DK, de Vries APJ, Bemelman FJ, van de Wetering J, et al. Equivalent Long-term Transplantation Outcomes for Kidneys Donated After Brain Death and Cardiac Death: Conclusions From a Nationwide Evaluation. EClinicalMedicine 2018; 4–5: 25–31.
- Actividad de donación y trasplante renal. España 2022. Organización Nacional de Trasplantes. https://www.ont.es/wp-content/uploads/2023/06/DONACION-Y-TRASPLANTE-RENAL-2022.pdf [Consultado 19 Dic 2023].
- Snoeijs MG, Schaubel DE, Hené R, Hoitsma AJ, Idu MM, Ijzermans JN, et al. Kidneys from donors after cardiac death provide survival benefit. J Am Soc Nephrol. 2010; 21: 1015–1021.
- Petit V, Lenain R, Debillon F, Hazzan M, Provot F. Association entre l’inscription sur liste d’attente de donneur à cœur arrêté contrôlé Maastricht III et le temps d’attente avant la transplantation rénale dans un centre français. Nephrol Ther 2022; 18: 604-610.
- Summers DM, Johnson RJ, Hudson A, Collett D, Watson CJ, Bradley JA. Effect of donor age and cold storage time on outcome in recipients of kidneys donated after circulatory death in the UK: a cohort study. Lancet 2013; 381: 727–734.
- Locke JE, Segev DL, Warren DS, Dominici F, Simpkins CE, Montgomery RA. Outcomes of kidneys from donors after cardiac death: implications for allocation and preservation. Am J Transplant 2007; 7: 1797-1807.
- Mirshekar-Syahkal B, Summers D, Bradbury LL, Aly M, Bardsley V, Berry M, et al. Local Expansion of Donation After Circulatory Death Kidney Transplant Activity Improves Waitlisted Outcomes and Addresses Inequities of Access to Transplantation. Am J Transplant 2017; 17: 390–340.
- de Kok MJC, Schaapherder AFM, Alwayn IPJ, Bemelman FJ, van de Wetering J, van Zuilen AD, et al. Improving outcomes for donation after circulatory death kidney transplantation: Science of the times. PLoS One 2020; 15: e0236662.
- Singh SK, Kim SJ. Does expanded criteria donor status modify the outcomes of kidney transplantation from donors after cardiac death? Am J Transplant 2013; 13: 329–336.
- Nagaraja P, Roberts GW, Stephens M, Horvath S, Kaposztas Z, Chavez R, et al. Impact of expanded criteria variables on outcomes of kidney transplantation from donors after cardiac death. Transplantation 2015; 99: 226–231.
- Yu S, Long JJ, Yu Y, Bowring MG, Motter JD, Ishaque T, et al. Survival benefit of accepting kidneys from older donation after cardiac death donors. Am J Transplant 2021; 21: 1138-1146.
- Pérez-Sáez MJ, Lafuente Covarrubias O, Hernández D, Moreso F, Melilli E, Juega J, et al. GEODAS Group. Early outcomes of kidney transplantation from elderly donors after circulatory death (GEODAS study). BMC Nephrol 2019; 20: 233.
- Peters-Sengers H, Berger SP, Heemskerk MB, Al Arashi D, Homan van der Heide JJ, Hemke AC, et al. Stretching the Limits of Renal Transplantation in Elderly Recipients of Grafts from Elderly Deceased Donors. J Am Soc Nephrol 2017; 28: 621–631.
- Montero N, Toapanta N, Pallarès N, Crespo M, Diekmann F, Guirado L, et al. Deciphering transplant outcomes of expanded kidney allografts donated after controlled circulatory death in the current transplant era. A call for caution. Transpl Int 2021; 34: 2494-2506.
- Reid AW, Harper S, Jackson CH, Wells AC, Summers DM, Gjorgjimajkoska O, et al. Expansion of the kidney donor pool by using cardiac death donors with prolonged time to cardiorespiratory arrest. Am J Transplant 2011; 11: 995–1005
- Phillips B, Asgari E, Berry M, Callaghan C, Cerisuelo MC, Johnson P, et al. British Transplantation Society guidelines on abdominal organ transplantation from deceased donors after circulatory death. Transplant Rev 2023: 100801.
- van Straalen E, Rijkse E, van Staa A, Rebers PM, Hagenaars HJAM, van de Wetering J, et al. Impact of Extraction Time During Donation After Circulatory Death Organ Procurement on Kidney Function After Transplantation in The Netherlands. Transplant Direct 2023; 9: e1538.
- Padilla M, Coll E, Fernández-Pérez C, Pont T, Ruiz Á, Pérez-Redondo M, et al. Improved short-term outcomes of kidney transplants in controlled donation after the circulatory determination of death with the use of normothermic regional perfusion. Am J Transplant 2021; 21: 3618-3628.
- Oniscu GC, Mehew J, Butler AJ, Sutherland A, Gaurav R, Hogg R, et al. Improved organ utilization and better transplant outcomes with in situ normothermic regional perfusion in controlled donation after circulatory death. Transplantation 2023; 107: 438–448.
- Tingle SJ, Figueiredo RS, Moir JA, Goodfellow M, Talbot D, Wilson CH. Machine perfusion preservation versus static cold storage for deceased donor kidney transplantation. Cochrane Database Syst Rev 2019; 3.
- Ravindra KV, Sanoff S, Vikraman D, Zaaroura A, Nanavati A, Sudan D, Irish W. Lymphocyte depletion and risk of acute rejection in renal transplant recipients at increased risk for delayed graft function. Am J Transplant 2019; 19: 781-789.
- Asderakis A, Sabah TK, Watkins WJ, Khalid U, Szabo L, Stephens MR, et al. Thymoglobulin Versus Alemtuzumab Versus Basiliximab Kidney Transplantation From Donors After Circulatory Death. Kidney Int Rep 2022; 7: 732-740.
MAT-ES-2400026 V1 - Enero 2024
